Company Building
Produktentwicklung im Gesundheitswesen – Wie geht das eigentlich?
von Lukas Kreimeier
Das Gesundheitswesen ist eine der größten und am schnellsten wachsenden Industrien weltweit und weist großartige Digitalisierungspotentiale in sämtlichen Bereichen auf. In den vergangenen Jahren sind demnach zahlreiche Startups aus dem Boden gesprossen, die sich vor allem damit beschäftigen Behandlungsqualitäten und Patientenerfahrungen über Mobile Apps wesentlich zu verbessern. Zu erkennen ist jedoch, dass sich die meisten Lösungen und Produkte vor allem auf Bereiche aus dem alltäglichen Praxisarztgeschäft oder Home-Fitness fokussieren. Prozessoptimierungen durch Hardware und Software-Produkte für Krankenhäuser sind im Vergleich viel rarer gesät. Und auch das hat einen Grund, denn arbeitet man an der Entwicklung eines tatsächlichen Medizinproduktes, dass im alltäglichen Krankenhausgeschäft in der Patientenbehandlung zum Einsatz kommt, ist der Weg von der ersten Idee bis zum finalen Produkt, dass auf dem Markt eingeführt werden kann steinig und auch sehr langwierig.
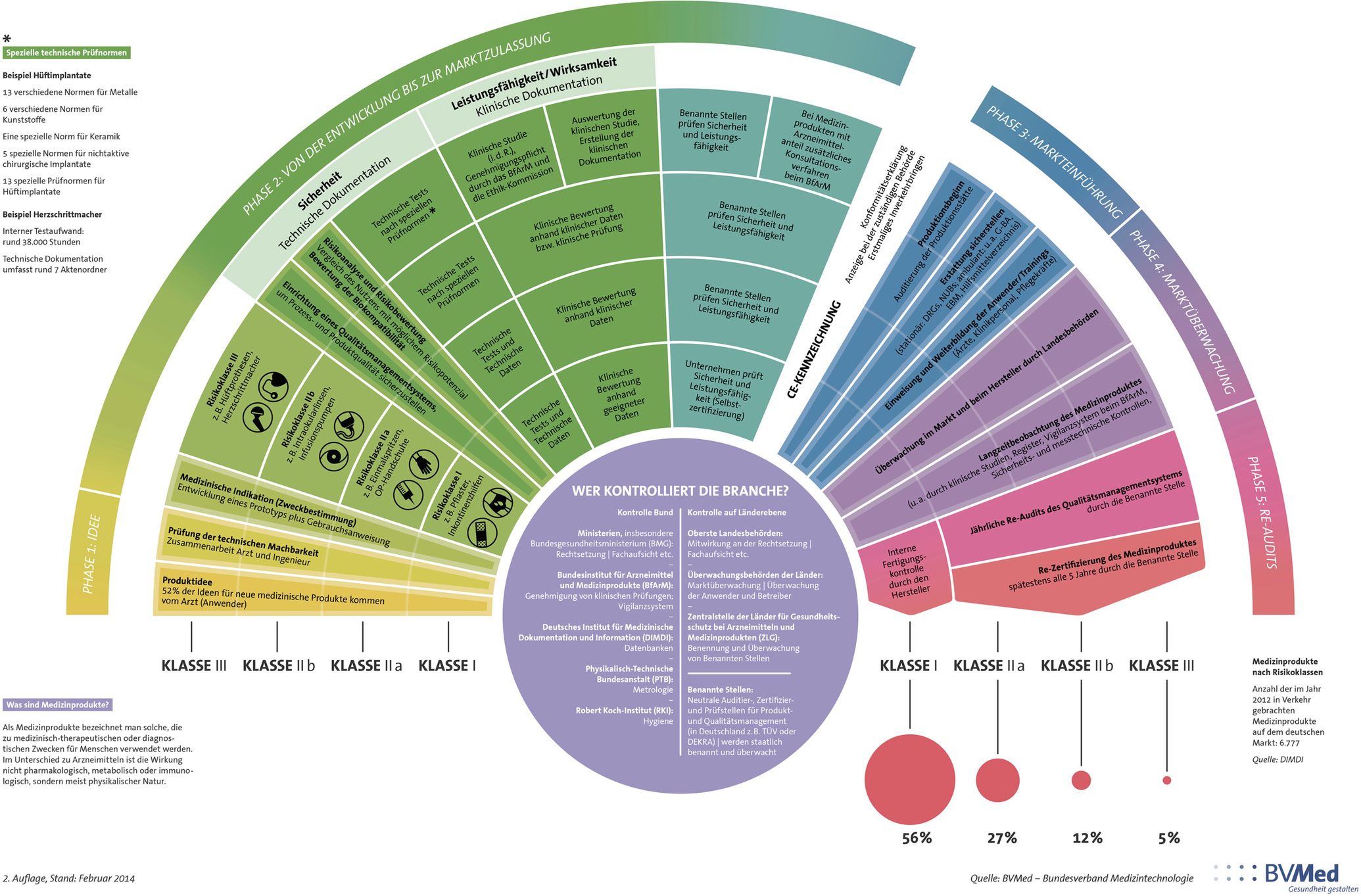
Dies liegt vor allem an den wichtigen regulatorischen Richtlinien, die an ein Medizinprodukt gestellt werden und in der MDR (Medical Device Regulation) klar und eindeutig geregelt sind. Die MDR ist der Leitfaden für die Entwicklung von Medizinprodukten, der vorgibt, was ein derartiges Produkt an Faktoren und Anforderungen erfüllen muss, um vertrieben und eingesetzt werden zu können.
Quelle: BVMed – Bundesverband Medizintechnologie
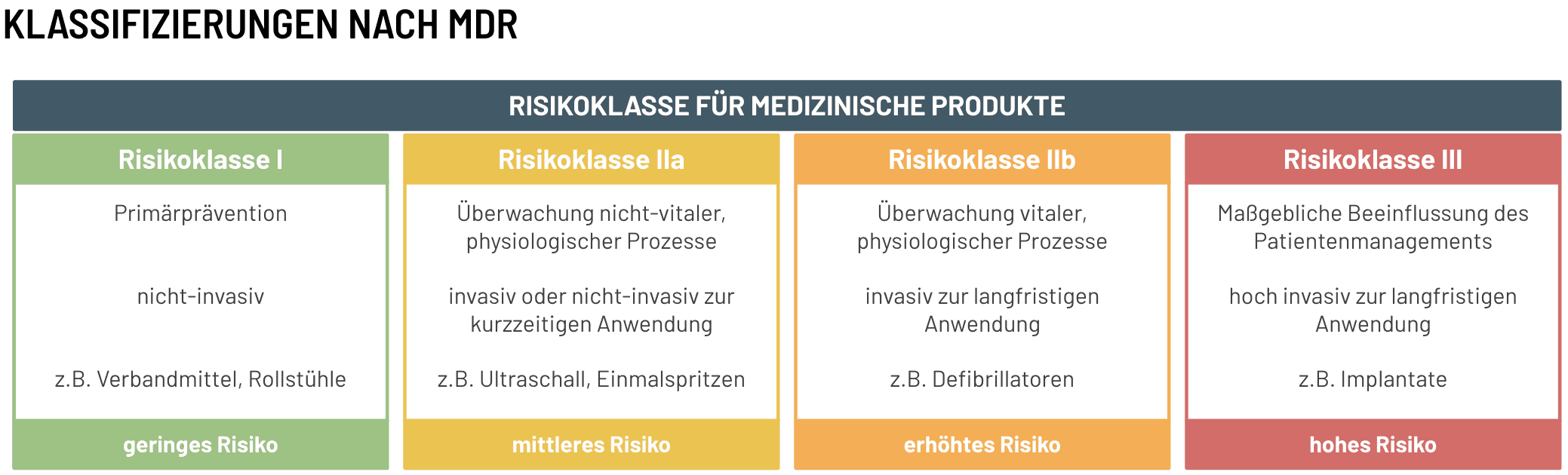
Da unterschiedliche Medizinprodukte, unterschiedliche Zwecke, und kritische oder weniger kritische Aufgaben in der Patientenbehandlung bewältigen, gibt es eine Aufteilung in vier unterschiedliche Risikoklassen (I, IIa, IIb, III). Ein Produkt der Risikoklasse I ist an viel geringere Anforderungen gebunden als ein Produkt der Risikoklasse III. Das liegt vor allem daran, dass ein Produkt der Risikoklasse I (beispielsweise ein Pflaster) eine gering kritische und nicht-invasive Funktion in der Patientenversorgung hat. Auf der anderen Seite übernehmen Produkte der Risikoklasse III (z.B. ein Herzschrittmacher) häufig überlebenswichtige, invasive Prozesse, bei denen es von größter Wichtigkeit ist, dass sie einwandfrei funktionieren und sämtliche Leistungs- und Sicherheitsanforderungen erfüllen – bei derartigen Produkten geht es in den meisten Fällen um die Überwachung der Vitalfunktionen eines Patienten.
Wichtig zu berücksichtigen ist außerdem, dass ab Risikoklasse IIa das Produkt einer klinischen Bewertung anhand klinischer Daten unterzogen werden muss. Bei Risikoklasse III sind die Ansprüche sogar nochmals höher, da man dort eine vollumfängliche klinische Studie durchführen muss. Nichtsdestotrotz bedarf es zur Generierung klinischer Daten eines Krankenhauses, in dem diese Daten erhoben werden können. Was vorerst einmal relativ einfach und unkompliziert klingt, bedeutet in der Realität jedoch eine im schlimmsten Falle sehr aufwendige und lange Suche nach einem Partnerkrankenhaus – dies liegt unter anderem daran, dass derartige Datenerhebungen oder sogar Studien für Krankenhäuser mit viel Zeit- und Ressourcenaufwand verbunden sind. Demnach sollte sich bereits frühzeitig damit auseinandergesetzt werden ein passendes kooperierendes Krankenhaus zu finden – im besten Fall nicht nur zur Durchführung notwendiger Tests und Studien, sondern direkt als Umsetzungs- und Entwicklungspartner.
Wurde eine Idee gefunden und diese der entsprechenden Risikoklasse zugeordnet, geht es im Folgenden darum, die jeweiligen Anforderungen der Risikoklasse zu erfüllen, um schlussendlich in der Lage zu sein, die CE-Kennzeichnung und somit die Marktzulassung für das Produkt zu erlangen.
Wir als GERMANTECH entwickeln seit nunmehr 2 Jahren im Auftrag eines österreichischen Familienunternehmens ein softwaregesteuertes Hardware-Medizinprodukt zur Flüssigkeitsbilanzierung der Risikoklasse IIa, also ein Produkt zur invasiven oder nicht-invasiven, kurzzeitigen Anwendung und Überwachung nicht-vitaler, physiologischer Prozesse.
Dies bedeutet, dass wir im Laufe der Produktentwicklung die Sicherheit und Leistungsfähigkeit des Produktes analysieren und validieren müssen. Dafür muss eine technische Dokumentation angefertigt werden, die technische Tests und Daten über das Medizinprodukt erhalten und Auskunft über die Produktsicherheit geben. Um die Leistungsfähigkeit beziehungsweise auch Wirksamkeit eines derartigen Produktes belegen zu können, benötigt es im nächsten Schritt noch eine klinische Bewertung anhand klinischer Daten. In unserem Fall ist dies die Durchführung einer klinischen Studie an einem österreichischen Universitätsklinikum, in der unser derzeitiger Prototyp in seinem definierten Anwendungsfeld auf Herz und Nieren überprüft und getestet wird – wichtig ist dabei vor allem die Validierung des medizinischen Nutzens und seiner Funktionsfähigkeit.
Zur finalen Zertifizierung fehlt dann nur noch das Konformitätsbewertungsverfahren, dass durch eine Benannte Stelle durchgeführt wird und in seiner Gesamtheit zwischen sechs und neun Monate in Anspruch nimmt. Um diesen Prozess überhaupt erst starten können, muss der zukünftige Inverkehrbringer des entwickelten Medizinproduktes einerseits eine vollständige Technische Dokumentation als auch ein dediziertes Qualitätsmanagementsystem anfertigen und vorweisen. Diese beiden Dokumente bilden die Grundlage für die Bewertung der Konformität und sind das entscheidende Kriterium, ob der Inverkehrbringer schlussendlich das angestrebte und notwendige CE-Kennzeichen erhält. Sobald dies geschehen ist, kann das Medizinprodukt nach langer Zeit der Entwicklung, Prüfung und Testung endlich in Verkehr gebracht werden.
Neben all den regulatorischen Prozessen und der Entwicklung und Verfeinerung des Produktes, sollte außerdem nicht vergessen werden, dass, sofern es sich um ein digitales Softwareprodukt handelt, eine weitere potentiell knifflige und wichtige Aufgabe die Integration der Software in das Krankenhausinformationssystem darstellt. Frühzeitig im Entwicklungsprozess sollte sich auch damit beschäftigt werden, wie das Produkt schlussendlich in die bestehende Systeme nahtlos integriert werden kann.
Abschließend muss gesagt werden, dass der gesamte Entwicklungsprozess von der Idee bis zum finalen CE-gekennzeichneten Medizinprodukt durchaus drei bis vier Jahre in Anspruch nehmen kann.
Nach mittlerweile zwei Jahren in der Entwicklung können wir ein erstes Fazit ziehen: Die Entwicklung eines Medizinproduktes ist derart zeit- und kostenintensiv, dass es Startups und Privatpersonen so gut wie verwehrt bleibt innovative und zukunftsweisende Medizinprodukte zu entwickeln und auf dem Markt zu etablieren. Dadurch wird das vielversprechende Potenzial, das das Gesundheitswesen in Zeiten der Digitalisierung aufweist, stark eingebremst. Dies kann jedoch nicht maßgeblich verhindert werden, da vor allem die regulatorischen Richtlinien die Produktentwicklung in die Länge ziehen, aber für das schlussendliche Produkt in seinem Anwendungsgebiet unerlässlich sind. Um einen erfolgreichen Entwicklungsprozess zu durchlaufen ist es demnach von großem Wert, wenn man an seiner Seite Partner hat, die ein gewisses Maß an Risikoaffinität und vor allem Geduld aufweisen. Ein Medizinprodukt auf den Markt zu bringen widerspricht dem so häufig im Innovationskontext angestrebtem Schnelligkeitsgedanken. Ein weiteres wichtiges Leitelement in der Produktentwicklung im Gesundheitswesen ist, dass ein Medizinprodukt immer anwenderzentrisch entwickelt werden muss. Das bedeutet, dass die schlussendliche Anwendergruppe (Ärzte, Pflegepersonal etc.) so früh wie möglich in den Gestaltungsprozess mit einbezogen werden muss. Das finale Produkt sollte nicht nur einen hohen medizinischen Nutzen aufweisen, sondern außerdem durch Anwenderfreundlichkeit und wahre Prozessoptimierung bestechen.
Bei GERMANTECH verfolgen wir einen für das Gesundheitswesen einzigartigen Entwicklungsansatz, bei dem wir von Anfang an bereits einige prozessuale Vorkehrungen treffen und Optimierungen einfließen lassen, um die Produktentwicklung so schlank und vielversprechend wie möglich zu gestalten. Werden Medizinprodukte häufig aufwendig, langwierig und teuer in klinischen Laboren entwickelt und getestet, besticht unsere Vorgehensweise durch ein hohes Maß an Agilität, Schnelligkeit und Anwenderzentriertheit. Von der ersten Minute an haben wir den Anwenderkreis unseres Zielproduktes mit in die Produktentwicklung inkludiert. Zusammen mit Ärzten und dem Pflegepersonal entwickeln wir ein Produkt, dass – in diesem Fall – auf der Intensivstation einen wahren und großen Mehrwert bietet und bereits vor dem finalen serienreifen Produkt ein validiertes Erfolgspotenzial darstellt. Somit beschleunigen wir den Entwicklungsprozess und validieren währenddessen kontinuierlich die Produktfunktionalität und seine Nutzerversprechen. Zusammengefasst entwickeln wir Medizinprodukte schneller, günstiger und erfolgsversprechender mit dem Ansatz den Nutzer und den Patienten allzeit in den Fokus der Produktentwicklung zu stellen.